З початку часу люди прагнули зрозуміти, з чого складається Всесвіт і все, що знаходиться всередині нього. І хоча стародавні волхви і філософи уявляли світ, що складається з чотирьох або п’яти елементів - землі, повітря, води, вогню (і металу, або свідомості) - класичною античністю, філософи почали теоретизувати, що вся матерія насправді складається з крихітного, невидимі та неподільні атоми.
З цього часу вчені брали участь у процесі постійного відкриття з атомом, сподіваючись відкрити його справжню природу та склад. До 20 століття наше розуміння стало вдосконалено до того, що ми змогли побудувати його точну модель. І протягом останнього десятиліття наше розуміння просунулося ще далі, до того, що ми підтвердили існування майже всіх його теоретизованих частин.
Сьогодні атомні дослідження зосереджені на вивченні будови та функції речовини на субатомному рівні. Це не тільки полягає у визначенні всіх субатомних частинок, які, як вважають, утворюють атом, але і дослідження сил, які ними керують. До них відносяться сильні ядерні сили, слабкі ядерні сили, електромагнетизм і сила тяжіння. Ось розбивка всього того, про що ми дізналися про атом поки що ...
Структура Атома:
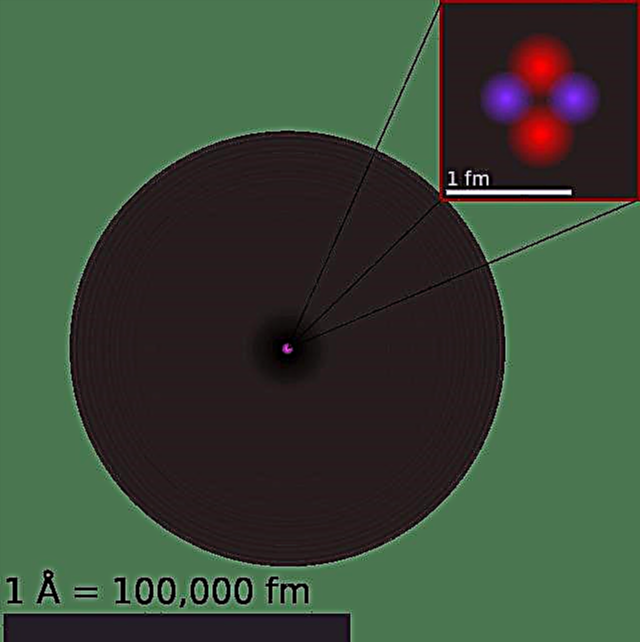
Нашу сучасну модель атома можна розбити на три складові частини - протони, нейтрони та електрони. Кожна з цих частин має пов'язаний заряд: протони несуть позитивний заряд, електрони мають негативний заряд і нейтрони не мають чистого заряду. Відповідно до Стандартної моделі фізики частинок протони та нейтрони складають ядро атома, а електрони обертають його в «хмарі».

Електрони в атомі притягуються до протонів в ядрі електромагнітною силою. Електрони можуть вийти зі своєї орбіти, але лише у відповідь на зовнішнє джерело енергії, що застосовується. Чим ближче орбіта електрона до ядра, тим більше приваблива сила; отже, тим сильніша зовнішня сила, необхідна для того, щоб змусити втекти електрона.
Електрони обходять навколо ядра по декількох орбітах, кожна з яких відповідає певному енергетичному рівню електрона. Електрон може змінити свій стан на більш високий рівень енергії, поглинаючи фотон з достатньою енергією, щоб перерости його в новий квантовий стан. Аналогічно, електрон у стані більш високої енергії може опуститися до нижчого енергетичного стану, випромінюючи надлишкову енергію у вигляді фотона.
Атоми є електрично нейтральними, якщо вони мають рівну кількість протонів і електронів. Атоми, які мають або дефіцит, або надлишок електронів, називають іонами. Електрони, віддалені від ядра, можуть переноситися на інші сусідні атоми або поділятися між атомами. За цим механізмом атоми здатні зв’язуватися в молекули та інші види хімічних сполук.
Усі три ці субатомні частинки - це Ферміони, клас частинок, пов’язаних із речовиною, яка або є елементарною (електронами), або складовою (протони та нейтрони). Це означає, що електрони не мають відомої внутрішньої будови, тоді як протони та нейтрони складаються з інших субатомних частинок. називаються кварками. Існує два типи кварків в атомах, які мають дробовий електричний заряд.

Протони складаються з двох «вгору» кварків (кожен із зарядом +2/3) та одного кварка «вниз» (-1/3), а нейтрони складаються з одного вище кварка та двох низхідних кварків. Це розрізнення пояснює різницю заряду між двома частинками, яка працює на заряд +1 і 0 відповідно, тоді як електрони мають заряд -1.
Інші субатомні частинки включають лептони, які поєднуються з Ферміонами, утворюючи будівельні блоки речовини. У сучасній атомній моделі є шість лептонів: частинки електрона, мюона та тау та пов'язані з ними нейтрино. Різні різновиди частинок Лептона, які зазвичай називають «ароматизаторами», диференціюються за розмірами та зарядами, що впливає на рівень їх електромагнітних взаємодій.
Потім з'являються калібрувальні бозони, які відомі як "носії сили", оскільки вони опосередковують фізичні сили. Наприклад, глюони відповідають за сильну ядерну силу, яка тримає кварки разом, а бозони W і Z (досі гіпотетичні) вважають, що відповідають за слабку ядерну силу, що стоїть за електромагнетизмом. Фотони є елементарною частинкою, яка утворює світло, в той час як Хіггс Босон відповідає за надання W і Z бозонам своєї маси.
Атомна маса:
Більшість маси атомів надходить з протонів та нейтронів, що складають його ядро. Електрони є найменш масовими з складових частинок атома, масою 9,11 х 10-31 кг і занадто малий розмір, щоб виміряти поточними методами. Протони мають масу, що в 1836 разів більша від електрона, на 1.6726 × 10-27 кг, а нейтрони - наймасовіший з цих трьох - 1,6929 × 10-27 кг (у 1839 разів перевищує масу електрона).

Загальна кількість протонів і нейтронів в ядрі атомів (званих "нуклонами") називається масовим числом. Наприклад, елемент Карбон-12 так називають, оскільки він має масову кількість 12 - похідний від його 12 нуклонів (шість протонів і шість нейтронів). Однак елементи також розташовуються на основі їх атомних чисел, що є таким самим, як кількість протонів, знайдених у ядрі. У цьому випадку Карбон має атомне число 6.
Справжню масу атома в спокої вимірювати дуже важко, оскільки навіть наймасовіші з атомів занадто легкі, щоб виражатись у звичайних одиницях. Як такий, вчені часто використовують уніфіковану атомну одиницю маси (u) - також звану дальтон (Da) - яка визначається як дванадцята частина маси вільного нейтрального атома вуглецю-12, що становить приблизно 1,66 × 10-27 кг.
Хіміки також використовують кротів, одиницю, що визначається як один моль будь-якого елемента, що завжди має однакову кількість атомів (приблизно 6,022 × 1023). Це число було вибрано таким чином, що якщо елемент має атомну масу 1 u, моль атомів цього елемента має масу, близьку до одного грама. Через визначення уніфікованої одиниці атомної маси кожен атом вуглецю-12 має атомну масу рівно 12 мкг, і тому моль вуглецю-12 атомів важить рівно 0,012 кг.
Радіоактивний розпад:
Будь-які два атоми, які мають однакову кількість протонів, належать до одного і того ж хімічного елемента. Але атоми з рівною кількістю протонів можуть мати різну кількість нейтронів, які визначаються як різні ізотопи одного і того ж елемента. Ці ізотопи часто нестабільні, і всі, з атомним числом яких перевищує 82, відомі як радіоактивні.
Коли елемент зазнає розпаду, його ядро втрачає енергію, випромінюючи випромінювання - яке може складатися з альфа-частинок (атомів гелію), бета-частинок (позитронів), гамма-променів (високочастотна електромагнітна енергія) та перетворюючих електронів. Швидкість, з якою нестабільний елемент занепадає, відома як "період напіввиведення", тобто кількість часу, необхідного для елементу впасти до половини його початкового значення.
На стійкість ізотопу впливає відношення протонів до нейтронів. З 339 різних типів елементів, які природним чином зустрічаються на Землі, 254 (близько 75%) були позначені як "стійкі ізотопи" - тобто не підлягають гниттю. Додаткові 34 радіоактивні елементи мають період напіввиведення довше 80 мільйонів років, і вони існують ще з ранньої Сонячної системи (тому їх називають "первинними елементами").
Нарешті, додатково 51 короткотривалий елемент, як відомо, відбувається природним чином, як "дочірні елементи" (тобто ядерні побічні продукти) розпаду інших елементів (наприклад, радію від урану). Крім того, недовговічні радіоактивні елементи можуть бути результатом природних енергетичних процесів на Землі, таких як космічні бомбардування (наприклад, вуглець-14, який відбувається в нашій атмосфері).
Історія навчання:
Найдавніші відомі приклади атомної теорії походять із Стародавньої Греції та Індії, де такі філософи, як Демокріт, постулювали, що вся матерія складається з крихітних, неподільних та незнищенних одиниць. Термін «атом» був введений в Стародавній Греції і породив школу думки, відому як «атомізм». Однак ця теорія була скоріше філософською концепцією, ніж науковою.
Лише в 19 столітті теорія атомів стала артикулюватися як наукова справа, провівши перші експерименти на основі доказів. Наприклад, на початку 1800-х рр. Англійський вчений Джон Далтон використав концепцію атома, щоб пояснити, чому хімічні елементи реагували певними спостережуваними та передбачуваними способами.
Далтон почав з питання, чому елементи реагували у співвідношеннях малих цілих чисел, і дійшов висновку, що ці реакції відбувалися в цілому числі кратних дискретних одиниць - іншими словами, атоми. Через серію експериментів з газами Далтон продовжив розробку того, що відомо як атомна теорія Далтона, яка залишається одним з наріжних каменів сучасної фізики та хімії.
Теорія зводиться до п’яти передумов: елементи, в їх найчистішому стані, складаються з частинок, званих атомами; атоми конкретного елемента - однакові, аж до останнього атома; атоми різних елементів можна розрізнити за їх атомними вагами; атоми елементів об’єднуються, утворюючи хімічні сполуки; атоми не можуть бути створені або знищені в хімічній реакції, тільки групування постійно змінюється.
В кінці 19 століття вчені почали теоретизувати, що атом складається з більш ніж однієї фундаментальної одиниці. Однак більшість вчених ризикнули, що ця одиниця буде розміром з найменшого відомого атома - водню. А потім у 1897 р. Через серію експериментів з використанням катодних променів фізик Дж. Дж. Томпсон оголосив, що виявив одиницю, яка була в 1000 разів меншою і в 1800 разів легшою за атом водню.

Його експерименти також показали, що вони були ідентичними частинкам, виділеним фотоефектом та радіоактивними матеріалами. Подальші експерименти показали, що ця частинка проводила електричний струм через металеві дроти та негативні електричні заряди всередині атомів. Отже, чому частинка, яку спочатку називали «тільцем», пізніше була змінена на «електрон», після того, як в 1874 році передбачив частинку Джорджа Джонстона Стоні.
Однак Томсон також постулював, що електрони розподіляються по всьому атомові, що було рівномірним морем позитивного заряду. Це стало відомим як «модель сливового пудингу», яка згодом виявиться неправильною. Це відбулося в 1909 році, коли фізики Ганс Гігер та Ернест Марсден (під керівництвом Ернеста Резерфода) провели свій експеримент, використовуючи металеву фольгу та альфа-частинки.
Відповідно до атомної моделі Далтона, вони вважали, що альфа-частинки пройдуть прямо через фольгу з невеликим відхиленням. Однак багато частинок були відхилені під кутом, більшим за 90 °. Щоб пояснити це, Резерфорд запропонував позитивний заряд атома зосереджений у крихітному ядрі в центрі.
У 1913 році фізик Нільс Бор запропонував модель, де електрони орбітували до ядра, але могли це зробити лише на обмеженій орбіті. Він також запропонував, що електрони можуть стрибати між орбітами, але лише в дискретних змінах енергії, відповідних поглинанню або випромінюванню фотона. Це не тільки вдосконалило запропоновану Резерфордом модель, але й породило концепцію квантованого атома, де матерія поводилась у невмілих пакетах.

Розробка мас-спектрометра - який використовує магніт для згинання траєкторії пучка іонів - дозволив вимірювати масу атомів з підвищеною точністю. Хімік Френсіс Вільям Астон використовував цей інструмент, щоб показати, що ізотопи мають різну масу. Цього, в свою чергу, дотримувався фізик Джеймс Чадвік, який у 1932 р. Запропонував нейтрон як спосіб пояснення існування ізотопів.
Протягом початку 20 століття квантова природа атомів розвивалася далі. У 1922 р. Німецькі фізики Отто Стерн та Уолтер Герлах провели експеримент, коли промінь атомів срібла був спрямований через магнітне поле, яке мало на меті розділити пучок між напрямком імпульсу (або спіна) атомів.
Відомий як експеримент Стерна-Герлаха, результати полягали в тому, що промінь розщеплювався на дві частини, залежно від того, орієнтувався чи ні спин атомів вгору чи вниз. У 1926 р. Фізик Ервін Шродінгер використав ідею, що частинки поводяться як хвилі, щоб розробити математичну модель, яка описувала електрони як тривимірні форми хвиль, а не просто частинки.
Наслідком використання форм хвиль для опису частинок є те, що математично неможливо отримати точні значення як положення, так і імпульсу частинки в будь-який момент часу. Того ж року Вернер Гейзенберг сформулював цю проблему і назвав її «принципом невизначеності». На думку Гейзенберга, для даного точного вимірювання положення можна отримати лише коло можливих значень імпульсу, і навпаки.

У 30-х роках фізики виявили ядерне поділ завдяки експериментам Отто Хана, Ліз Мейтнер та Отто Фріш. Експерименти Гана включали спрямування нейтронів на атоми урану в надії створити трансуранієвий елемент. Натомість процес перетворив його зразок урану-92 (Ур92) на два нові елементи - барій (B56) та криптон (Кр27).
Мейтнер і Фріш перевірили експеримент і віднесли його до розщеплення атомів урану, утворюючи два елементи з однаковою загальною вагою атома, процес, який також вивільнив значну кількість енергії шляхом розриву атомних зв'язків. У наступні роки розпочалися дослідження можливої зброї цього процесу (тобто ядерної зброї) і призвели до побудови перших атомних бомб у США до 1945 року.
У 1950-х роках розробка вдосконалених прискорювачів частинок та детекторів частинок дозволила вченим вивчити вплив атомів, що рухаються з високою енергією. З цього була розроблена Стандартна модель фізики частинок, яка до цих пір успішно пояснювала властивості ядра, існування теоретизованих субатомних частинок та сили, що керують їх взаємодіями.
Сучасні експерименти:
З другої половини XX століття в атомній теорії та квантовій механіці було відкрито багато нових і захоплюючих відкриттів. Наприклад, у 2012 році тривалий пошук Хіггса Босона призвів до прориву, коли дослідники, що працюють в Європейській організації ядерних досліджень (CERN) у Швейцарії, оголосили про своє відкриття.

В останні десятиліття фізики приділяли багато часу і енергії розробці єдиної теорії поля (ака. Велика об'єднаюча теорія або теорія всього). По суті, з моменту вперше запропонованої Стандартної моделі вчені намагалися зрозуміти, як працюють чотири основні сили Всесвіту (сила тяжіння, сильні та слабкі ядерні сили та електромагнетизм).
Якщо гравітацію можна зрозуміти, використовуючи теорії відносності Ейнштейна, а ядерні сили та електромагнетизм можна зрозуміти за допомогою квантової теорії, жодна теорія не може враховувати всі чотири сили, що працюють разом. Спроби вирішити це призвели до низки запропонованих теорій протягом багатьох років, починаючи від теорії струн і закінчуючи квантовою гравітацією циклу. На сьогодні жодна з цих теорій не призвела до прориву.
Наше розуміння атома пройшло довгий шлях - від класичних моделей, які розглядали його як інертне тверде тіло, яке механічно взаємоділо з іншими атомами, до сучасних теорій, де атоми складаються з енергетичних частинок, які ведуть себе непередбачувано. Хоча минуло кілька тисяч років, наші знання про фундаментальну структуру всієї матерії значно просунулися.
І все ж залишається багато таємниць, які ще належить вирішити. З часом і постійними зусиллями ми можемо нарешті розкрити останні залишки секрету атома. Знову ж таки, цілком може бути, що будь-які нові відкриття, які ми робимо, породжуватимуть лише більше запитань - і вони можуть бути ще більш заплутаними, ніж ті, що були раніше!
Ми написали багато статей про атом для Space Magazine. Ось стаття про атомну модель Джона Далтона, атомну модель Нілса Бора, ким був Демокрит? Та скільки атомів у Всесвіті?
Якщо вам потрібна додаткова інформація про атом, перегляньте статтю НАСА про аналіз крихітних проб, і ось посилання на статтю НАСА про атоми, елементи та ізотопи.
Ми також записали цілий епізод "Астрономічної ролі" про Атом. Слухайте тут, Епізод 164: Всередині Атома, Епізод 263: Радіоактивний розпад та Епізод 394: Стандартна модель, Бозони.